悪性高熱症
悪性高熱症(あくせいこうねつしょう、英: malignant hyperthermia, MH)は、全身麻酔の併発症の一つで、唯一の特効薬であるダントロレンによる対処法が確立されて以降、発症しても死亡率は17.5%(1991年)[1]にまで低下しているものの、依然として全身麻酔による合併症の中では最も死亡率が高い。全身麻酔に使用される多くの薬剤で発症し、特に、ハロタンをはじめとした全ての吸入麻酔薬およびスキサメトニウムをはじめとした脱分極性筋弛緩薬によることが知られている[2]。これらの薬剤が骨格筋細胞のリアノジン受容体RyR1のカルシウム誘発性カルシウム放出を暴走させ、筋小胞体内のカルシウムと、筋細胞内のATPを筋収縮と発熱を引き起こしながら消費し尽くし、体温が制御できなくなり、適切な処置が行われないと死亡する。ヒトのみでなく、イヌ、ウマ、ブタ等にも存在する。
| 悪性高熱症 | |
|---|---|
 悪性高熱症の多くはリアノジン受容体1型遺伝子(RyR1)の変異による | |
| 分類および外部参照情報 | |
| 診療科・ 学術分野 | 救急医学, 神経学 |
| ICD-10 | T88.3 |
| ICD-9-CM | 995.86 |
| OMIM | 145600 154275 154276 600467 601887 601888 |
| DiseasesDB | 7776 |
| MeSH | D008305 |
| GeneReviews | |
ダントロレンで治療する点や症状が悪性症候群と類似しているが、同じ原因遺伝子を含む可能性を残しながら、基本的には別の疾患として取り扱われる。
原因
この疾患は通常は常染色体優性遺伝する。遺伝子として最も良く知られていて、確実に分かっているものはリアノジン受容体1型の遺伝子(RyR1)である。RyR1はセントラルコア病(CCD)の原因遺伝子でもあり、CCDはMHと同様に常染色体優性遺伝で、全身麻酔の際にMHを発症することがあり、欧米ではMHとCCDの両方の特徴を持つ患者がいることが知られていた。2006年に日本でも研究が行われ、その結果、日本のCCD患者の90%で、RyR1が原因遺伝子であることが証明された[3]。
欧米ではMHとCCDのように特定のイオンチャネルに関連する複数の疾患をチャネロパチーの概念でとりまとめて、同じ土台の上で議論しようとする傾向がある。
疫学
MHの発症率は全身麻酔手術およそ100,000例に1~2例と低いが、その年齢分布、性別分布には特徴がある。重度のMHであるMH劇症型の日本での分布は、男女比は3.5:1であり、30歳未満の症例だけで66%を占めた[4]。同文献中の表3から男性では、10歳未満の発症が全年齢区分の中で最も多く、次に20歳代、10歳代と続く。死亡率が最も高いのは30歳代で、次に20歳代、10歳代と続く。
症状
MHは全身麻酔の術中や、稀に術後に発症する。兆候は患者の全身管理(生命維持全般)を担っている麻酔科医が最初に気付くことが多い。特徴的な症状は骨格筋の硬直、酸素消費量の増大、二酸化炭素産生量の増大を伴う代謝高進状態(カプノグラフィーによる高炭酸ガス血症)、頻脈、異常な高熱(15分間に0.5℃以上の上昇、時には42℃以上)である。横紋筋融解症を併発することが多く、その場合、ポートワイン尿といわれるミオグロビンを含む赤黒い尿、10,000IU/リットル以上のクレアチンキナーゼ (CK)、またそれらが腎臓で詰まることによる腎不全が起こる。
かつては一般的であったが、現在では稀にしか使用されない揮発性吸入麻酔薬ハロタンがMHのトリガーとして最も知られているが、発症率はハロタンほどでないものの、他のあらゆるハロゲン化揮発性麻酔薬がトリガーである。神経筋遮断薬スキサメトニウムもMHのトリガーである。MHはトリガーとなる薬剤を投与されると必ず発症するわけではない。素因性のある患者でも、最初の全身麻酔で発症せず、何回かの全身麻酔の後に発症することもある。通常、投与から1時間以内に発症するが、数時間後、稀に術後に発症することもある。
対処
MHの兆候が見られた場合、体温上昇を抑えるための全身冷却と並行して、唯一の特効薬であるダントロレンを水に溶かして点滴する。また、MHの発症を確認するために多くの検査が行われる。血液検査では、CKの上昇、カリウム濃度の上昇、リン酸塩の上昇、ミオグロビン濃度の上昇がある。代謝性アシドーシス、呼吸性アシドーシス、またはその両方が起こる。横紋筋融解症が重度の場合、急性腎不全を引き起こすことがあるので、腎機能を測定する。
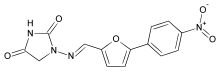
ダントロレンは、MHと悪性症候群への対処には不可欠であるものの、その注射用製剤は他の用途に用いられることはほとんどない高価な薬剤であり、病院では余裕を持って常備できない場合がある(経口用カプセル製剤は痙性麻痺への適応もあり、高価でもまれな薬剤でもないので混同しないよう注意されたい)。そのためダントロレン相互援助が運用されていた[5]。だが、この相互援助は2022現在では機能していないようである。
ダントロレンは直接リアノジン受容体に働き、カルシウムの放出を阻害する筋弛緩剤である。
臨床診断基準
1994年のコンセンサス会議において、診断基準が定められた。スコアが高いほど(6より高ければ)、悪性高熱症であると考えられる。[6]
素因性検査
MHの素因性または感受性とは、遺伝的にMHを発症する要素を持っていること、トリガーとなる薬剤を投与されると発症するリスクがあることを意味する。素因性検査または素因性診断とは、素因性があるかどうか調べるための検査や診断である。素因性検査には、骨格筋検査と遺伝子検査がある。2010年3月現在、遺伝子検査とは、MH劇症型のおよそ6~7割に対して敏感度を有すると見込まれているRyR1遺伝子検査を意味する。骨格筋検査とは、日本ではCICR検査を意味し[7]、欧米では筋拘縮テストを意味する。筋拘縮テストは、米国とカナダではCHCTを意味し、ヨーロッパ、オーストラリア、ニュージーランドではIVCTを意味する。
主な検査法である骨格筋検査では、筋生検の小手術を必要とするため、肉体的・金銭的負担が大きい。日本では平成9年から広島大学のCICR検査が高度先進医療に採用[8]され、健康保険への導入が期待されている。2010年3月に広島大学に続いて埼玉医科大学のCICR検査も高度先進医療に採用された[9]。
骨格筋検査よりも患者への負担が少ないRyR1遺伝子検査が国立精神神経センターとの共同研究で実施された[10][11]。
日本で実施されている骨格筋検査であるCICR検査は、2010年3月現在、広島大学病院麻酔科と埼玉医科大学病院麻酔科の2つの病院で行われており、筋生検による小手術を伴う検査である。検査自体は、成人の場合、日帰りで検査可能な場合が多い。小児の場合の筋生検は全身麻酔で行われ、安全な全身麻酔薬を用いる入院検査である。
予防
患者は、素因性結果の検査結果が陽性であれば、緊急手術の際の麻酔科医に素因者であることを伝えるために、悪性高熱症友の会が会員に配布しているペンダント[12]や、IDタグを身につけることで対策ができる。同様のタグやカードが他国でもみられる[13]。
機序

悪性高熱症の大部分(50-70%)は、骨格筋細胞中のカルシウムを貯蔵する器官である筋小胞体(SR)上にある、リアノジン受容体1型(RyR1)の変異により引き起こされる[14][15] [16]。 RyR1は、L型カルシウムチャネルが伝達する細胞内Ca2+濃度の増大に反応して開口し、その結果、細胞内カルシウム濃度が急激に増大し、筋収縮が起こる。RyR1には、Ca2+濃度の変化に反応するために重要な部位が2つあると考えられており、それぞれA部位、I部位と呼ばれる。A部位は、RyR1が開口することを伝達するための、高親和性のCa2+結合部位である。I部位は、RyR1が閉口することを伝達する低い親和性の部位である。カフェイン、ハロタン、および他のトリガーとなる薬剤は、変異したRyR1中で、A部位のCa2+の親和性を急激に増大し、同時にI部位の親和性を減少させる。Mg2+も、A部位かI部位のいずれか作用することによりRyR1が閉口する原因になるので、RyR1の活性化に影響を及ぼす。MH変異を引き起こしたRyR1では、これらの一方の部位でMg2+の親和性が大きく低下する。こうした変性の結果、活性化閾値が低くなり、非活性化閾値が高くなることにより、Ca2+放出が大きく増大する[17][18]。この過剰なCa2+を再吸収するプロセスは、大量のATP(アデノシン三燐酸)を消費し、過度の熱(高体温)、すなわちこの疾患の特質をもたらす。筋線維はATPの枯渇および高体温により損傷を受け、細胞の構成要素であるカリウム、ミオグロビン、クレアチン、リン酸塩、クレアチンキナーゼなどが、血流に「漏れ出る」(横紋筋融解症)。
他の知られているMH原因遺伝子はCACNA1S、L型電位依存性カルシウムチャネルαサブユニットである。このタンパク質には2つの変異が知られており、両方とも同じ残基(R1086)に影響を及ぼす[19][20]。 この残基はタンパク質ドメイン3および4を接続している大きな細胞内ループの中に位置していて、おそらく不の方向にRyR1活性が調節されるのに関係していると考えられている。このように変異したチャネルをHEK 293細胞(ヒト胎児由来腎臓細胞)で発現させると、カフェイン(おそらくハロタンも)による活性化に5倍の敏感度を示し、5~10mV大きく過分極して活性化する。これらのチャネルを発現した細胞は、細胞基質Ca2+の基底濃度が増大する。こうしたチャネルはRyR1と相互作用を起こしたりRyR1を活性化したりするので、最終的にはこれらの変性により細胞内Ca2+が劇的に増加し、筋の興奮性が増す[21]。
動物モデル
悪性高熱症の研究は、在来種のブタに「ブタストレス症候群」が発見されるまでは限定されたものであった。ブタがストレスにさらされてこの疾患を発症すると"pale, soft, exudative"と言われた品質の悪い肉質となり、畜産業者にとっては売り物にならないものであった。この目が覚めている間のトリガー("Awake Triggering")現象は当時ヒトでは観測されず、初期にはブタを動物モデルとして用いることに疑問の声もあったが、後にヒトでも素因者はストレスの多い状況で"Awake Trigger"(悪性高熱症を発症)することが分かった。このことにより悪性高熱症の研究には動物モデルとしてブタが用いられることとなった。
ブタで同様の変異が発表されてからやっと、Gillardらがヒトの責任変異因子を発見した[14]。
ウマも悪性高熱症に罹患する。素因性があると見出されたのはサラブレッドで、過労、麻酔、ストレスにより発症する[22]。
ヒトにみられるR163C変異をもったMHマウスが構築された。このマウスはハロタンに感受性を示し、呼吸の増加、高体温、死亡といったヒトのMH患者に似た症状を呈した。ダントロレンによりRyR1を遮断すると、これらのマウスはヒトの場合と同様にハロタンに有害反応を示さなくなった。これらのマウスからの筋についても K+誘発脱分極の増加およびカフェイン感受性の増大が見られた[23]。
歴史
1962年にDenboroughらによって発表されたオーストラリアでの報告が最初である[24]。同様の反応がブタでも認められた[25]。
ダントロレンで治療できることを発見したのは南アフリカの麻酔科医であるGaisford Harrisonであり、1975年に報告した[26]。多くの動物実験の後、1982年にはヒトでその有効性を確認した[27]。
悪性高熱症が登場する作品・記事
- 麻酔 悪性高熱症による死亡事故 - ウェイバックマシン(2003年1月18日アーカイブ分) ドキュメンタリー「麻酔 医療被害者たちの叫び」 (制作: 石川テレビ) 1999年和解の際に病院にダントロレン常備を確約。
- 2002年高校生男子が死亡[28]。この場合もダントロレンの不備に親族が不満を訴えた。
- 日本のテレビドラマDr.コトー診療所2006の第6話「息子への誓い」の中で、中学生の山下邦夫が腹膜炎(絞扼性(複雑性)イレウス)を起こして手術中に、麻酔薬により悪性高熱症を引き起こすシーンがある。体温が41.5度まで上昇したのを氷で冷却して一命を取り留める。
- テレビドラマ「医龍-Team Medical Dragon-3」で、心臓パラガングリオーマの患者に対する手術中に悪性高熱症を発症、直腸温が40℃まで上がる中で手術を続行するシーンが描かれている。(なおこのドラマの中では体温上昇が5分に1℃ずつとされている)
脚注
- 菊池 2006, p. 155.
- 菊池 2006, pp. 72, 79.
- Wu S, Ibarra MC, Malicdan MC, Murayama K, Ichihara Y, Kikuchi H, Nonaka I, Noguchi S, Hayashi YK, Nishino I (2006). “Central core disease is due to RYR1 mutations in more than 90% of patients”. Brain 129 (6): 1470-80. PMID 16621918.
- 菊池 2006, pp. 69–70.
- 悪性高熱症友の会. “ダントロレン相互援助ネットワーク”. 2010年3月17日閲覧。
- Larach MG, Localio AR, Allen GC, et al (1994). “A clinical grading scale to predict malignant hyperthermia susceptibility”. Anesthesiology 80 (4): 771–9. doi:10.1097/00000542-199404000-00008. PMID 8024130.
- 菊池 2006, pp. 93–151.
- 厚生労働省. “平成21年6月30日時点で実施されていた先進医療の実績報告について”. 2010年3月28日閲覧。
- 厚生労働省. “先進医療を実施している医療機関の一覧”. 2010年3月28日閲覧。
- Ibarra M CA, Wu S, Murayama K, Minami N, Ichihara Y, Kikuchi H, Noguchi S, Hayashi YK, Ochiai R, Nishino I (2006). “Malignant hyperthermia in Japan: mutation screening of the entire ryanodine receptor type 1 gene coding region by direct sequencing”. Anesthesiology 104 (6): 1146-54. PMID 16732084.
- 市原 靖子, Carlos A. Ibarra Moreno, 菊地 博達 (2006). “悪性高熱症とセントラルコア病”. 日本臨床麻酔学会誌 26: 215-224. doi:10.2199/jjsca.26.215.
- 悪性高熱症友の会. “4.会員証、ペンダントヘッドの配付”. 2010年3月10日閲覧。
- “Malignant Hyperthermia - English”. 2010年3月30日閲覧。
- Gillard E, Otsu K, Fujii J, Khanna V, de Leon S, Derdemezi J, Britt B, Duff C, Worton R, MacLennan D (1991). “A substitution of cysteine for arginine 614 in the ryanodine receptor is potentially causative of human malignant hyperthermia”. Genomics 11 (3): 751–5. doi:10.1016/0888-7543(91)90084-R. PMID 1774074.
- Galli L, Orrico A, Lorenzini S, Censini S, Falciani M, Covacci A, Tegazzin V, Sorrentino V (2006). “Frequency and localization of mutations in the 106 exons of the RyR1 gene in 50 individuals with malignant hyperthermia”. Hum Mutat 27 (8): 830. doi:10.1002/humu.9442. PMID 16835904.
- 竹島 浩 (2003). “リアノジン受容体と結合膜構造”. 日本薬理学雑誌 121 (4): 203-210. doi:10.1254/fpj.121.203.
- Balog E, Fruen B, Shomer N, Louis C (2001). “Divergent effects of the malignant hyperthermia-susceptible Arg(615)->Cys mutation on the Ca(2+) and Mg(2+) dependence of the RyR1”. Biophys J 81 (4): 2050–8. PMID 11566777. オリジナルの2008年12月2日時点におけるアーカイブ。. PMC 1301678
- Yang T, Ta T, Pessah I, Allen P (2003). “Functional defects in six ryanodine receptor isoform-1 (RyR1) mutations associated with malignant hyperthermia and their impact on skeletal excitation-contraction coupling”. J Biol Chem 278 (28): 25722–30. doi:10.1074/jbc.M302165200. PMID 12732639.
- Monnier N, Procaccio V, Stieglitz P, Lunardi J (1997). “Malignant-hyperthermia susceptibility is associated with a mutation of the alpha 1-subunit of the human dihydropyridine-sensitive L-type voltage-dependent calcium-channel receptor in skeletal muscle”. Am J Hum Genet 60 (6): 1316–25. doi:10.1086/515454. PMID 9199552. PMC 1716149
- The R1086C mutant has never been published, but has nevertheless been referenced multiple times in the literature, e.g. Jurkat-Rott K, McCarthy T, Lehmann-Horn F (2000). “Genetics and pathogenesis of malignant hyperthermia”. Muscle Nerve 23 (1): 4–17. doi:10.1002/(SICI)1097-4598(200001)23:1<4::AID-MUS3>3.0.CO;2-D. PMID 10590402.
- Weiss R, O'Connell K, Flucher B, Allen P, Grabner M, Dirksen R (2004). “Functional analysis of the R1086H malignant hyperthermia mutation in the DHPR reveals an unexpected influence of the III-IV loop on skeletal muscle EC coupling”. Am J Physiol Cell Physiol 287 (4): C1094–102. doi:10.1152/ajpcell.00173.2004. PMID 15201141.
- Valberg SJ, Mickelson JR, Gallant EM, MacLeay JM, Lentz L, de la Corte F (1999). “Exertional rhabdomyolysis in quarter horses and thoroughbreds: one syndrome, multiple aetiologies”. Equine Vet J Suppl 30: 533–8. PMID 10659313.
- Yang T, Riehl J, Esteve E, et al (2006). “Pharmacologic and functional characterization of malignant hyperthermia in the R163C RyR1 knock-in mouse”. Anesthesiology 105 (6): 1164–75. doi:10.1097/00000542-200612000-00016. PMID 17122579.
- Denborough MA, Forster JF, Lovell RR, Maplestone PA, Villiers JD (1962). "Anaesthetic deaths in a family". British Journal of Anaesthesia. 34: 395–6. doi:10.1093/bja/34.6.395. PMID 13885389。 Historical account in Denborough MA (2008). “Malignant hyperthermia. 1962”. Anesthesiology 108 (1): 156–7. doi:10.1097/01.anes.0000296107.23210.dd. PMID 18156894.
- Hall LW, Woolf N, Bradley JW, Jolly DW (1966). “Unusual reaction to suxamethonium chloride”. Br Med J 2 (5525): 1305. PMID 5924819. PMC 1944316
- Harrison GG (1975). “Control of the malignant hyperpyrexic syndrome in MHS swine by dantrolene sodium”. British Journal of Anaesthesia 47 (1): 62–5. PMID 1148076. "Citation Classic"(高被引用論文)となったこの記事のリプリントを、Br J Anaesth81 (4): 626–9. PMID 9924249 (全文無料)より閲覧可能。
- Kolb ME, Horne ML, Martz R (1982). “Dantrolene in human malignant hyperthermia”. Anesthesiology 56 (4): 254–62. doi:10.1097/00000542-198204000-00005. PMID 7039419.
- ロハス・メディカル (2008年6月21日). “医療の良心を守る市民の会|ニュース”. 2010年3月8日閲覧。
外部リンク
日本
- 悪性高熱症友の会 - ウェイバックマシン(2002年10月3日アーカイブ分)
- 埼玉医科大学麻酔学講座による悪性高熱症ホームページ
- 広島大学悪性高熱症サイト