一本鎖マイナス鎖RNAウイルス
一本鎖マイナス鎖RNAウイルス(いっぽんさマイナスさRNAウイルス、英: Negative-sense single-stranded RNA virus、Negative-strand RNA virus、略称: (−)ssRNAウイルス) は、(−)鎖の一本鎖RNAからなるゲノムを持つウイルスのグループである。(−)鎖のゲノムは、ウイルスのRNA依存性RNAポリメラーゼ(RdRp)がmRNAを合成する際に相補鎖として機能する。ウイルスゲノムの複製の際、RdRpは(+)鎖のアンチゲノムを合成し、それを鋳型として(−)鎖のRNAゲノムを合成する。(−)ssRNAウイルスは他にも共通した特徴が多く存在する。その大部分はウイルスゲノムを収納するカプシドを覆うエンベロープを持っており、通常直鎖状のゲノムを持ち、ゲノムは分節化しているのが一般的である。
| (−)ssRNAウイルス | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||
| 分類 | ||||||||||||
| ||||||||||||
| 亜門 | ||||||||||||
|
本文参照 |
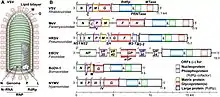
(−)ssRNAウイルスは、リボウイルス域(Riboviria)オルソルナウイルス界(Orthornavirae)ネガルナウイルス門(Negarnaviricota)を構成する。二本鎖RNAウイルスを共通祖先に持ち、レオウイルスの姉妹群であると考えられている。門の中では2つの主要な亜門に分類される。ハプロウイルス亜門(Haploviricotina)のメンバーの大部分はゲノムが分節化されておらず、mRNAのキャップを合成するRdRpをコードしている。ポリプロウイルス亜門(Polyploviricotina)のメンバーはゲノムが分節化されており、宿主のmRNAからキャップ部分を切り取る(キャップスナッチング)RdRpをコードしている。この門では、総計6つの綱が知られている。
(−)ssRNAウイルスは節足動物と密接に関係しており、伝染を節足動物に依存しているウイルスと、現在では節足動物の助けを借りずに脊椎動物で複製することができるようになったウイルスとに非公式な分類がなされることもある。有名な節足動物媒介性の(−)ssRNAウイルスには、リフトバレー熱ウイルスやトマト黄化えそウイルスがある。特筆すべき脊椎動物の(−)ssRNAウイルスとしては、エボラウイルス、ハンタウイルス、インフルエンザウイルス、ラッサウイルス、狂犬病ウイルスが挙げられる。
特徴
ゲノム
(−)ssRNAウイルスは、一本鎖のRNAからなるゲノムを持っている。ゲノムは(−)鎖であり、このことはウイルスのRdRpによって直接ゲノムからmRNAを合成できることを意味している。RdRpはRNAレプリカーゼとも呼ばれ、すべての(−)ssRNAウイルスによってコードされている。テヌイウイルス属(Tenuivirus)のウイルスとミウイルス属(Mivirus)の一部のウイルスを除いて、(−)ssRNAウイルスは環状ではなく直鎖状のゲノムを持っている。ゲノムは分節化している場合もしていない場合もある[1][2][3]。すべての(−)ssRNAウイルスのゲノムの末端には逆向き反復配列が存在し、ゲノムの両端は回文配列となっている[4]。
複製と転写

(−)ssRNAウイルスのゲノムの複製はRdRpによって行われ、RdRpはゲノムの3'末端のリーダー配列に結合して複製を開始する。その後、RdRpは(−)鎖のゲノムを鋳型として(+)鎖のアンチゲノムを合成する。アンチゲノムの複製の際には、RdRpはまずアンチゲノムの3'末端のトレーラー配列に結合する。その後、RdRpはアンチゲノム上の全ての転写シグナルを無視し、アンチゲノムを鋳型としてゲノムのコピーを合成する[5]。複製はゲノムがヌクレオカプシド内にある際に行われ、複製の過程でRdRpはカプシドをほどいてゲノムに沿って移動する。RdRpによって新たなヌクレオチド配列が合成されると、カプシドタンパク質は組み立てられ、新たに複製されたウイルスRNAを包み込む[6]。
ゲノムからのmRNAの転写は、アンチゲノムの産生と同じ方向に行われる。リーダー配列では、RdRpは5'末端の三リン酸RNAを合成し、ハプロウイルス亜門の場合は5'末端にキャップを付加し、ポリプロウイルス亜門の場合は宿主のmRNAからキャップスナッチングを行ってウイルスmRNAへ付加することで宿主細胞のリボソームが翻訳できる状態にする[7][8][9]。
mRNAへのキャップ付加の後、RdRpは開始コドン部位の転写を開始し、終止コドンに到達すると転写を終結する。転写の終結地点では、RdRpはmRNAの3'末端に数百個のアデニンからなるポリアデニル化テール(ポリ(A)テール)を付加する。この過程はウラシル配列でのスタッタリングによって行われている可能性がある。ポリ(A)テールが構築されると、mRNAはRdRpから放出される。複数の転写可能部位がコードされているゲノムでは、RdRpは次なる転写のために次の開始コドンのスキャニングを継続することができる[7][10]。
一部の(−)ssRNAウイルスはアンビセンス(ambisense)であり、このことは(−)鎖のゲノムと(+)鎖のアンチゲノムがそれぞれ異なるタンパク質をコードしていることを意味している。アンビセンスウイルスの転写は、ゲノムからの直接的なmRNAの産生とアンチゲノムからのmRNAの形成の2回の転写が行われる。すべてのアンビセンスウイルスには、タンパク質をコードするmRNAが転写された後に転写を止めるためのヘアピンループ構造が含まれている[11]。
形態

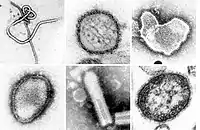
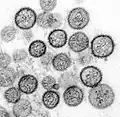
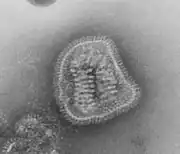
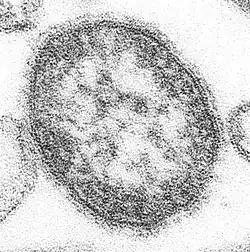
(−)ssRNAウイルスは、カプシドに囲まれたゲノムと各ゲノム断片に結合したRdRpからなるリボヌクレオタンパク質複合体を含んでいる[12]。カプシドは、5本のαヘリックスを含むN末端ローブ(5-Hモチーフ)と3本のαヘリックスを含むC末端ローブ(3-Hモチーフ)へとフォールディングするタンパク質から構成されている。カプシド内では、ゲノムはこれら2つのモチーフに挟まれている[6]。アスピウイルス科(Aspiviridae)を除いて、(−)ssRNAウイルスは、カプシドを囲む一種の脂質膜であるエンベロープを持っている。(−)ssRNAウイルスの場合、ビリオンと呼ばれるウイルス粒子の形状はフィラメント状、球状、管状、多形性のものなどさまざまである[13]。
系統学

RdRpに基づいた系統学的解析によって、(−)ssRNAウイルスはすべて共通の祖先に由来し、それは二本鎖RNAウイルスであるレオウイルスの姉妹群である可能性が高いことが示されている。ネガルナウイルス門の中では2つの明瞭な分岐が存在し、RdRpがウイルスmRNAのキャップを合成するか、宿主のmRNAからのキャップスナッチングによってウイルスmRNAへキャップを付加するかによって、2つの亜門に分類されている[1][2]。
ネガルナウイルス門の中では、節足動物に感染する(−)ssRNAウイルスが基部に位置し、他の全ての(−)ssRNAウイルスの祖先であるようである。節足動物は巨大な集団で生育することが多く、ウイルスは容易に伝染することができる。時とともに、節足動物の(−)ssRNAウイルスは高度の多様性を獲得した。節足動物は大量のウイルスの宿主となっているが、節足動物の間で(−)ssRNAウイルスの異種間伝播が生じる程度に関しては議論がある[3][4]。
植物と脊椎動物の(−)ssRNAウイルスは、節足動物に感染するウイルスと遺伝的に関係している。さらに、節足動物以外の大部分の(−)ssRNAウイルスも節足動物と相互作用することが示されている。そのため、節足動物は(−)ssRNAウイルス伝染の宿主と媒介者の双方としてはたらく。伝染に関して、非節足動物の(−)ssRNAウイルスは伝染を節足動物に依存しているものと、節足動物の助けがなくとも脊椎動物の間に広がるものとに区別される。後者のグループは前者のグループに起源を持ち、脊椎動物のみでの伝染に適応したものであるようである[4]。
分類
ネガルナウイルス門は、リボウィリアレルム、オルソルナウイルス界に属する。オルソルナウイルス界にはRdRpをコードするすべてのRNAウイルスが含まれ、リボウィリアレルムはオルソルナウイルス界と、逆転写酵素をコードするすべてのウイルスが属するパラルナウイルス界(Pararnavirae)が含まれる。ネガルナウイルス門には2つの亜門が存在し、合計6つの綱が含まれる。そのうち5つは単型である[6][9][15]。

- ハプロウイルス亜門 Haploviricotina - ウイルスmRNAのキャップ構造を合成するRdRpをコードする(−)ssRNAウイルスが含まれ、通常分節化されていないゲノムを持つ。
- 綱: Chunquiviricetes
- 目: Muvirales
- 科: Qinviridae
- 属: Yingvirus
- 科: Qinviridae
- 目: Muvirales
- 綱: Milneviricetes
- 目: Serpentovirales
- 科: Aspviridae
- 属: オフィオウイルス属 Ophiovirus
- 科: Aspviridae
- 目: Serpentovirales
- 綱: Monjiviricetes
- 綱: Yunchangviricetes
- 目: Goujianvirales
- 科: Yueviridae
- 属: Yuyuevirus
- 科: Yueviridae
- 目: Goujianvirales
- 綱: Chunquiviricetes
- ポリプロウイルス亜門 Polyploviricotina - ウイルスmRNAのキャップとして宿主のmRNAのキャップを利用するRdRpをコードする(−)ssRNAウイルスが含まれ、分節化されたゲノムを持っている。
- 綱: エリオウイルス綱 Ellioviricetes
- 目: ブニヤウイルス目 Bunyavirales
- 綱: インストウイルス綱 Insthoviricetes
- 目: アーティキュラウイルス目[16](アルティクラウイルス目[17]) Articulavirales
- 綱: エリオウイルス綱 Ellioviricetes
ウイルスをmRNAの産生様式に基づいて分類するボルティモア分類では、(−)ssRNAウイルスは第5群(Group V)に分類される。そのため、第5群とネガルナウイルス門は同義である[1]。
疾患
(−)ssRNAウイルスは、広く知られた多くの疾患の原因となっている。それらの中には節足動物によって媒介されるものも多く、リフトバレー熱ウイルスやトマト黄化えそウイルスなどが含まれる[18][19]。脊椎動物の中ではコウモリと齧歯類が多くのウイルスの共通媒介者となっており、エボラウイルスや狂犬病ウイルスはコウモリや他の脊椎動物によって媒介され[20][21]、ラッサウイルスとハンタウイルスは齧歯類によって媒介される[22][23]。インフルエンザウイルスは鳥類と哺乳類に共通のウイルスである[24]。ヒト特異的な(−)ssRNAウイルスには、麻疹ウイルスやムンプスウイルスがある[25][26]。
歴史
(−)ssRNAウイルスによって引き起こされる疾患は歴史を通じて知られており、ハンタウイルス感染症や麻疹、狂犬病が挙げられる[27][28][29]。現代では、エボラ出血熱やインフルエンザによって命に関わるアウトブレイクが引き起こされてきた[30][31]。水胞性口炎ウイルスは1925年に単離され、培養細胞を用いて研究することが可能であったため、研究が行われた最初の動物ウイルスの1つであった。このウイルスは(−)ssRNAウイルスであることが特定され、当時発見されていたウイルスは(+)鎖のウイルスであったため独特なものであった[32][33]。ウシの疾患である牛疫は(−)ssRNAウイルスの牛疫ウイルスによって引き起こされるが、21世紀初頭に根絶された。これはDNAウイルスによって引き起こされる天然痘に続く、2つ目の根絶された疾患である[34]。
21世紀には、ウイルスメタゲノミクスが環境中のウイルスを同定する一般的手法となった。(−)ssRNAウイルスに関しては、この手法によって無脊椎動物、とくに節足動物のウイルスが多数同定され、(−)ssRNAウイルスの進化的歴史に対する洞察に寄与した。RdRpの系統学的解析をもとに、すべての(−)ssRNAウイルスがネガルナウイルス門の共通祖先の子孫であることが示された。2018年には2つの亜門が創設され、その後新たに創設されたリボウィリアレルムのもとに位置付けられた[1][35]。
ギャラリー
出典
- “Megataxonomy of negative-sense RNA viruses” (docx) (英語). International Committee on Taxonomy of Viruses (ICTV) (2017年8月21日). 2020年8月6日閲覧。
- “Origins and Evolution of the Global RNA Virome”. mBio 9 (6): e02329-18. (27 November 2018). doi:10.1128/mBio.02329-18. PMC 6282212. PMID 30482837 2020年8月6日閲覧。.
- “Re-assessing the diversity of negative strand RNA viruses in insects”. PLoS Pathog 15 (12): e1008224. (12 December 2019). doi:10.1371/journal.ppat.1008224. PMC 6932829. PMID 31830128 2020年8月6日閲覧。.
- “Unprecedented genomic diversity of RNA viruses in arthropods reveals the ancestry of negative-sense RNA viruses”. eLife (4): e05378. (29 January 2015). doi:10.7554/eLife.05378. PMC 4384744. PMID 25633976 2020年8月6日閲覧。.
- “Negative stranded RNA virus replication”. ViralZone. Swiss Institute of Bioinformatics. 2020年8月6日閲覧。
- “Nucleocapsid Structure of Negative Strand RNA Virus”. viruses 12 (8): 835. (30 July 2020). doi:10.3390/v12080835 2020年8月6日閲覧。.
- “Negative-stranded RNA virus transcription”. ViralZone. Swiss Institute of Bioinformatics. 2020年8月6日閲覧。
- “Cap snatching”. ViralZone. Swiss Institute of Bioinformatics. 2020年8月6日閲覧。
- “Classify viruses - the gain is worth the pain”. Nature 566 (7744): 318-320. (February 2019). doi:10.1038/d41586-019-00599-8. PMID 30787460 2020年8月6日閲覧。.
- “Negative-stranded RNA virus polymerase stuttering”. ViralZone. Swiss Institute of Bioinformatics. 2020年8月6日閲覧。
- “Ambisense transcription in negative stranded RNA viruses”. ViralZone. Swiss Institute of Bioinformatics. 2020年8月6日閲覧。
- “Structural perspective on the formation of ribonucleoprotein complex in negative-sense single-stranded RNA viruses”. Trends Microbiol 21 (9): 475-484. (September 2013). doi:10.1016/j.tim.2013.07.006. PMID 23953596.
- Fermin, G. (2018). Viruses: Molecular Biology, Host Interactions and Applications to Biotechnology. Elsevier. p. 19-27, 43. doi:10.1016/B978-0-12-811257-1.00002-4. ISBN 9780128112571
- “Characterization of a Novel Orthomyxo-like Virus Causing Mass Die-Offs of Tilapia”. mBio 7 (2): e00431-16. (5 April 2016). doi:10.1128/mBio.00431-16. PMC 4959514. PMID 27048802 2020年8月6日閲覧。.
- “Virus Taxonomy: 2019 Release”. talk.ictvonline.org. International Committee on Taxonomy of Viruses. 2020年8月6日閲覧。
- 緒方靖哉・西山孝・土居克実「改訂 ウイルス分類 話題のウイルスの知見と動向」『化学と生物』第58巻 1号、日本農芸化学会、2020年、 20-33頁。
- 「国際ウイルス分類委員会の新しい分類体系(「ICTV New Taxonomy Release(2019)」)で提唱された目より上位の分類(2020年3月承認)」神谷茂 監修、錫谷達夫・松本哲哉 編『標準微生物学 第14版』付録、医学書院、2021年、表27-4、2022年10月23日閲覧。
- “Rift Valley Fever”. Clin Lab Med 37 (2): 285-301. (June 2017). doi:10.1016/j.cll.2017.01.004. PMC 5458783. PMID 28457351.
- “Top 10 plant viruses in molecular plant pathology”. Mol Plant Pathol 12 (9): 938-954. (December 2011). doi:10.1111/j.1364-3703.2011.00752.x. PMC 6640423. PMID 22017770 2020年8月6日閲覧。.
- “Ebola Virus Disease in Humans: Pathophysiology and Immunity”. Curr Top Microbiol Immunol 411: 141-169. (2017). doi:10.1007/82_2017_11. PMC 7122202. PMID 28653186 2020年8月6日閲覧。.
- “The spread and evolution of rabies virus: conquering new frontiers”. Nat Rev Microbiol 16 (4): 241-255. (April 2018). doi:10.1038/nrmicro.2018.11. PMC 6899062. PMID 29479072.
- “Pathogenesis of Lassa fever”. Viruses 4 (10): 2031-2048. (9 October 2012). doi:10.3390/v4102031. PMC 3497040. PMID 23202452 2020年8月6日閲覧。.
- “Hantavirus infections”. Clin Microbiol Infect 21S: e6-e16. (April 2019). doi:10.1111/1469-0691.12291. PMID 24750436 2020年8月6日閲覧。.
- “Animal influenza virus infections in humans: A commentary”. Int J Infect Dis 88: 113-119. (November 2019). doi:10.1016/j.ijid.2019.08.002. PMID 31401200 2020年8月6日閲覧。.
- “Transmission of Measles”. cdc.gov. Centers for Disease Control and Prevention (CDC) (2018年2月5日). 2020年8月6日閲覧。
- “Molecular biology, pathogenesis and pathology of mumps virus”. J Pathol 235 (2): 242-252. (January 2015). doi:10.1002/path.4445. PMC 4268314. PMID 25229387 2020年8月6日閲覧。.
- “Hantavirus infection: a global zoonotic challenge”. Virol Sin 32 (1): 32–43. (2017). doi:10.1007/s12250-016-3899-x. PMC 6598904. PMID 28120221.
- “Measles history”. cdc.gov. Centers for Disease Control and Prevention (CDC) (2018年2月5日). 2020年8月6日閲覧。
- “The history of rabies in the Western Hemisphere”. Antiviral Res 146: 221-232. (October 2017). doi:10.1016/j.antiviral.2017.03.013. PMC 5620125. PMID 28365457 2020年8月6日閲覧。.
- “General introduction into the Ebola virus biology and disease”. Folia Med Cracov 54 (3): 57-65. (2014). PMID 25694096 2020年8月6日閲覧。.
- “Influenza”. Nat Rev Dis Primers 4 (1): 3. (28 June 2018). doi:10.1038/s41572-018-0002-y. PMC 7097467. PMID 29955068 2020年8月6日閲覧。.
- “Vesicular stomatitis virus”. Swine Health Information Center. Center for Food Security and Public Health, College of Veterinary Medicine, Iowa State University (2015年11月). 2020年8月6日閲覧。
- “A short biased history of RNA viruses”. RNA 21 (4): 667-669. (April 2015). doi:10.1261/rna.049916.115. PMC 4371325. PMID 25780183 2020年8月6日閲覧。.
- “The contribution of vaccination to global health: past, present and future”. Philos Trans R Soc Lond B Biol Sci 369 (1645): 20130433. (12 May 2014). doi:10.1098/rstb.2013.0433. PMC 4024226. PMID 24821919 2020年8月6日閲覧。.
- “ICTV Taxonomy history: Negarnaviricota”. Internatinal Committee on Taxonomy of Viruses (ICTV). 2020年8月6日閲覧。
関連文献
- Ward, C. W. (1993). “Progress towards a higher taxonomy of viruses”. Research in Virology 144 (6): 419–53. doi:10.1016/S0923-2516(06)80059-2. PMC 7135741. PMID 8140287.

_EM_PHIL_2175_lores.jpg.webp)

_EM_18_lores.jpg.webp)