ロイコトリエンA4ヒドロラーゼ
ロイコトリエンA4ヒドロラーゼ(Leukotriene-A4 hydrolase)またはLTA4Hは、ヒトの遺伝子である[1][2][3]。この遺伝子によってコードされるタンパク質(EC 3.3.2.6)は、ロイコトリエンA4をロイコトリエンB4に変換し、またアミノペプチダーゼとしても働く2機能酵素である[4]。
| leukotriene A4 hydrolase | |
|---|---|
 阻害剤のウベニメクスとの錯体を形成したLTA4Hの結晶構造(N末端:青色、C末端:赤色) | |
| 識別子 | |
| 略号 | LTA4H |
| Entrez | 4048 |
| HUGO | 6710 |
| OMIM | 151570 |
| PDB | 1SQM (RCSB PDB PDBe PDBj) |
| RefSeq | NM_000895 |
| UniProt | P09960 |
| 他のデータ | |
| EC番号 (KEGG) | 3.3.2.6 |
| 遺伝子座 | Chr. 12 q22 |
機能
この酵素は加水分解酵素、特にエーテル加水分解酵素に分類される。系統名は、(7E,9E,11Z,14Z)-(5S,6S)-5,6-エポキシイコサ-7,9,11,14-テトラエン酸ヒドロラーゼ((7E,9E,11Z,14Z)-(5S,6S)-5,6-epoxyicosa-7,9,11,14-tetraenoate hydrolase)である。その他に、TA4 hydrolase、LTA4H、leukotriene A4 hydrolase等とも呼ばれる。この酵素は、アラキドン酸の代謝に関与している。
触媒反応
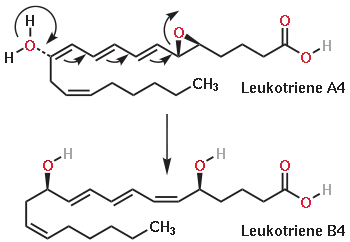
LTA4Hによって触媒される化学反応
構造
2007年末時点で、この酵素の4つの構造が解明されている。蛋白質構造データバンクのコードは、1GW6、1H19、1HS6、1SQMである。
出典
- Minami M, Ohno S, Kawasaki H, Radmark O, Samuelsson B, Jornvall H, Shimizu T, Seyama Y, Suzuki K (October 1987). “Molecular cloning of a cDNA coding for human leukotriene A4 hydrolase. Complete primary structure of an enzyme involved in eicosanoid synthesis”. J. Biol. Chem. 262 (29): 13873-6. PMID 3654641.
- FFunk CD, Radmark O, Fu JY, Matsumoto T, Jornvall H, Shimizu T, Samuelsson B (October 1987). “Molecular cloning and amino acid sequence of leukotriene A4 hydrolase”. Proc. Natl. Acad. Sci. U.S.A. 84 (19): 6677-81. doi:10.1073/pnas.84.19.6677. PMC 299146. PMID 2821541.
- Mancini JA, Evans JF (July 1995). “Cloning and characterization of the human leukotriene A4 hydrolase gene”. Eur. J. Biochem. 231 (1): 65-71. doi:10.1111/j.1432-1033.1995.tb20671.x. PMID 7628486.
- Rudberg PC, Tholander F, Andberg M, Thunnissen MM, Haeggstrom JZ (June 2004). “Leukotriene A4 hydrolase: identification of a common carboxylate recognition site for the epoxide hydrolase and aminopeptidase substrates”. J. Biol. Chem. 279 (26): 27376-82. doi:10.1074/jbc.M401031200. PMID 15078870.
関連文献
- Evans JF, Dupuis P, Ford-Hutchinson AW (1985). “Purification and characterisation of leukotriene A4 hydrolase from rat neutrophils”. Biochim. Biophys. Acta. 840 (1): 43–50. doi:10.1016/0304-4165(85)90160-6. PMID 3995081.
- Shimizu T, Seyama Y, Suzuki K (1987). “Molecular cloning of a cDNA coding for human leukotriene A4 hydrolase. Complete primary structure of an enzyme involved in eicosanoid synthesis”. J. Biol. Chem. 262 (29): 13873–6. PMID 3654641.
- Haeggstrom J, Meijer J, Radmark O (1986). “Leukotriene A4. Enzymatic conversion into 5,6-dihydroxy-7,9,11,14-eicosatetraenoic acid by mouse liver cytosolic epoxide hydrolase”. J. Biol. Chem. 261 (14): 6332–7. PMID 3009453.
- Newman JW, Morisseau C, Hammock BD (2005). “Epoxide hydrolases: their roles and interactions with lipid metabolism”. Prog. Lipid. Res. 44 (1): 1–51. doi:10.1016/j.plipres.2004.10.001. PMID 15748653.
- Fretland AJ, Omiecinski CJ (2000). “Epoxide hydrolases: biochemistry and molecular biology”. Chem. Biol. Interact. 129 (1-2): 41–59. doi:10.1016/S0009-2797(00)00197-6. PMID 11154734.
- Orning L, Gierse JK, Fitzpatrick FA (1994). “The bifunctional enzyme leukotriene-A4 hydrolase is an arginine aminopeptidase of high efficiency and specificity”. J. Biol. Chem. 269 (15): 11269–73. PMID 8157657.
- S, Yotsumoto H, Takaku F, Shimizu T (1987). “Leukotriene A4 hydrolase in the human lung. Inactivation of the enzyme with leukotriene A4 isomers”. J. Biol. Chem. 262 (21): 10200–5. PMID 3038871.
外部リンク
- leukotriene A4 hydrolase - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.