ギボシラン
ギボシランナトリウム[1](Givosiran)は、成人の急性肝性ポルフィリン症の治療薬である[2]。急性肝性ポルフィリン症は、ヘムの生合成の中間体である分子が異常に蓄積し毒性を示す遺伝子疾患である[3][4]。ギボシランは、ヘムの生成に重要な酵素である5-アミノレブリン酸合成酵素を阻害する低分子干渉RNA(siRNA)である[5]。
 | |
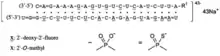 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Givlaari |
| Drugs.com | monograph |
| ライセンス | US Daily Med:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与方法 | 皮下注射 |
| 識別 | |
| CAS番号 | 1639325-43-1 |
| ATCコード | A16AX16 (WHO) |
| PubChem | CID: 119058042 |
| DrugBank | DB15066 |
| UNII | ROV204583W |
| KEGG | D11702 |
| 化学的データ | |
| 化学式 | C524H694F16N173O316P43S6 |
| 分子量 | 16,300.42 g·mol−1 |
| |
| |
副作用
重大な副作用とされているものは[10]、
- アナフィラキシー(0.9%)
- 肝機能障害(13.5%) - ALT増加、AST増加、γ-GTP増加など
- 腎機能障害(13.5%) - 慢性腎臓病、血中クレアチニン増加、糸球体濾過率減少など
である。
作用機序
急性肝性ポルフィリン症(AHP)は肝臓でのヘモグロビン合成酵素群の一部が欠損する疾患であり[12]、合成中間体であるアミノレブリン酸(ALA)やポルフォビリノーゲン(PBG)が過剰に蓄積し、神経毒性や腹部症状を呈する[13]。AHPは欠損酵素により4病型に分類されるが、いずれも5’-アミノレブリン酸合成酵素1(ALAS1 )遺伝子の誘導が見られる[12]。
ギボシランはALAS1 の伝令RNA(mRNA)に干渉する二本鎖低分子干渉RNA(siRNA)であり、肝臓に選択的に運搬する目的でアシアロ糖タンパク質受容体[注 1]に結合するN-アセチルガラクトサミンが連結されている。
同siRNAはALAS1 のmRNAに干渉してその分解を促進させ、ALAやPBGの血中濃度を減少させてAHPの症状を抑制する[10]。
脚注
- アシアロ糖タンパク質は、血中の糖タンパク質(多くの場合はシアル酸が付加されている)が劣化してシアル酸が脱離した状態のタンパク質である。肝臓に、補足して分解するための特異的受容体が存在する[14]。
参考資料
- “KEGG DRUG: ギボシラン”. www.kegg.jp. 2021年10月13日閲覧。
- “Givosiran: A Review in Acute Hepatic Porphyria”. Drugs 81 (7): 841–848. (May 2021). doi:10.1007/s40265-021-01511-3. PMID 33871817.
- "FDA approves first treatment for inherited rare disease". U.S. Food and Drug Administration (FDA) (Press release). 20 November 2019. 2019年11月21日時点のオリジナルよりアーカイブ。2019年11月20日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。 - "FDA approves givosiran for acute hepatic porphyria". U.S. Food and Drug Administration (FDA) (Press release). 20 November 2019. 2019年11月21日時点のオリジナルよりアーカイブ。2019年11月20日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。 - “Givosiran”. 2021年10月13日閲覧。
- “Drug Trials Snapshots: Givlaari”. U.S. Food and Drug Administration (FDA) (2019年11月20日). 2020年1月24日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。 - “急性肝性ポルフィリン症治療薬「ギブラーリ®」 の製造販売承認を取得”. 2021年10月13日閲覧。
- “New Drug Therapy Approvals 2019”. U.S. Food and Drug Administration (2019年12月31日). 2020年9月15日閲覧。
- “2020年6月25日 薬事・食品衛生審議会 薬事分科会 議事録”. www.mhlw.go.jp. 2021年10月13日閲覧。
- “ギブラーリ皮下注189mg 添付文書”. www.info.pmda.go.jp. 2021年10月13日閲覧。
- “Givosiran label”. 2021年10月13日閲覧。
- 日経メディカル. “急性肝性ポルフィリン症に対するsiRNA製剤”. 日経メディカル. 2021年10月13日閲覧。
- “急性ポルフィリン症 - 10. 内分泌疾患と代謝性疾患”. MSDマニュアル プロフェッショナル版. 2021年10月13日閲覧。
- 第2版, 化学辞典. “アシアロ糖タンパク質とは”. コトバンク. 2021年10月13日閲覧。
外部リンク
- “Givosiran”. Drug Information Portal. U.S. National Library of Medicine (NLM). 2021年10月13日閲覧。
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.